Enlace químico
Proyecto Salón Hogar
Un enlace es la
unión entre los átomos de un compuesto. Esta unión se origina en
la estructura electrónica de los mismos. La actividad química de
los elementos radica en su tendencia a adquirir, mediante su
unión con otros átomos, la configuración de gas noble (ocho
electrones en la capa más externa, salvo el helio, que solo
tiene dos), que es muy estable.
Generalmente, se consideran tres
tipos principales de enlaces químicos: iónico,
covalente y metálico. Aunque dichos enlaces tienen
propiedades bien definidas, la clasificación no es rigurosa,
existiendo una transición gradual de uno a otro, lo que permite
considerar tipos de enlace intermedios. Por ejemplo la sal común
está formada por un no metal, el cloro, y un metal alcalino, el
sodio. En estado puro, ambos son extremadamente peligrosos para
el hombre; sin embargo, juntos forman una sustancia, que es
inocua en pequeñas cantidades. Se dice, por tanto, que han
formado un compuesto químico, una sustancia muy diferente de los
elementos que la componen. Muchas de las sustancias que
conocemos están formadas por uniones de distintos elementos.
|
GEOMETRÍA DE LAS MOLÉCULAS PARTIENDO DE LOS
ORBITALES DE VALENCIA |
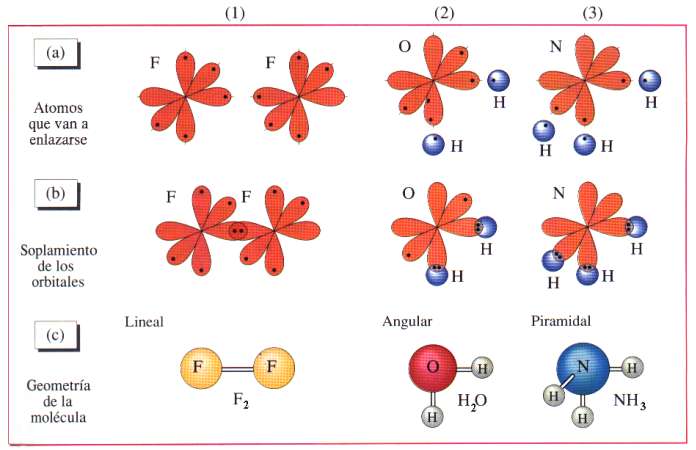 |
|
HIBRIDACIÓN Y SUS CARACTERÍSTICAS |
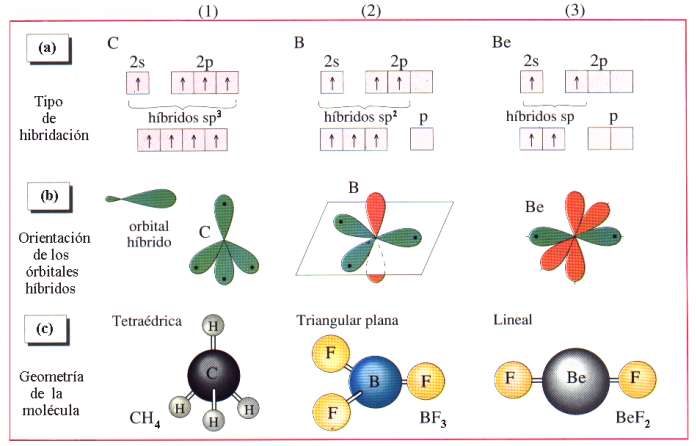 |
Tipos de enlace químico
El enlace iónico consiste
en la atracción electrostática (algo parecido a la
atracción de las limaduras de hierro por un imán) entre átomos
con cargas eléctricas de signo contrario. Este tipo de enlace se
establece entre átomos de elementos electropositivos (elementos
con carga positiva) con los de elementos electronegativos
(elementos con carga negativa). De esta manera, el enlace se
suele producir entre un no metal (electronegativo) y un metal (electropositivo)
y en este es necesario que uno de los elementos pueda ganar
electrones y el otro perderlo.
Un ejemplo de sustancia con
enlace iónico es el cloruro de sodio, en cuya formación se da la
transferencia de un electrón del átomo de sodio al átomo de
cloro. Las configuraciones electrónicas de estos elementos
después del proceso de ionización (es decir, la formación de
elementos con carga eléctrica denominados iones) son muy
importantes, ya que los dos han conseguido la configuración
externa correspondiente a los gases nobles, ganando los átomos
en estabilidad. Se produce una transferencia electrónica, cuyo
déficit se cubre sobradamente con la energía que se libera al
agruparse los iones formados en una red cristalina que, en el
caso del cloruro de sodio, es una red cúbica en la que en los
vértices del paralelepípedo (similar a una caja) fundamental
alternan iones Cl- y Na+. De esta forma, cada ion Cl- queda
rodeado de seis iones Na+, y recíprocamente. Se llama índice
de coordinación al número de iones de signo contrario que
rodea a uno determinado en una red cristalina. En el caso del
cloruro de sodio, el índice de coordinación es seis para ambos.
En el enlace covalente no
existe atracción electrostática, como en el caso anterior. Aquí
la situación es totalmente diferente, pues en este caso dos
átomos se unen más íntimamente; es decir, ambos comparten algo
en común. Y lo común entre estos átomos es un electrón ubicado
en la capa más externa. Así, uno de los átomos se acerca al otro
ofreciéndole el electrón de su capa más externa, y el otro átomo,
al estar en esta circunstancia, también se acerca y ofrece el
electrón más externo de su capa electrónica. Así se encuentran
ambos átomos y tanto el electrón de uno como del otro
interactúan entre sí, y se da una unión muy fuerte.
El enlace metálico se
realiza entre elementos metálicos. Así, los elementos metálicos
sin combinar forman redes cristalinas (similares a una red de
pescar) con elevado índice de coordinación (es decir, agrupación
de átomos de manera ordenada). En el enlace metálico, los átomos
se desplazan alrededor de muchos átomos. Intuitivamente, la red
cristalina metálica puede considerarse formada por una serie de
átomos alrededor de los cuales los electrones sueltos forman una
nube que mantiene unido al conjunto.
|
La electrovalencia
y la covalencia |
|
La
electrovalencia, valencia en la
formación de compuestos iónicos, es el
número de electrones que el átomo tiene
que ganar o perder para conseguir la
configuración de los gases nobles.
La
covalencia, número de enlaces covalentes
que puede formar un átomo, es el número
de electrones desapareados que tiene
dicho átomo. Hay que tener presente que
un átomo puede desaparear sus electrones
al máximo, siempre que para ello no haya
de pasar ningún electrón a un nivel
energético superior. |
|
|
|